Een oplossing verdunnen, dat is een bekende handeling in veel laboratoria. Heb je ooit een instructie gezien zoals “bereid 100 mL van een verdunde oplossing” en dacht je: waar begin ik? Je bent niet de enige. Verdunnen is een van de meest voorkomende handelingen in de chemie, van middelbare schoolpractica tot professioneel onderzoek. Het goede nieuws: zodra je de logica begrijpt, wordt het voorspelbaar en bijna mechanisch.
In deze gids lees je wat verdunnen precies betekent, hoe de formule werkt en hoe je een verdunning veilig en correct uitvoert.
Wat betekent “een oplossing verdunnen”?

Verdunnen betekent dat je de concentratie van een oplossing verlaagt door extra oplosmiddel toe te voegen, meestal demiwater. Het kernidee is simpel:
Je verwijdert de opgeloste stof niet; je verdeelt die over een groter volume.
Denk aan het toevoegen van water aan een glas sinaasappelsap. De smaak wordt minder sterk, maar de hoeveelheid sap is niet verdwenen. In de chemie werkt het precies zo.
Bij het verdunnen van een oplossing:
- De hoeveelheid opgeloste stof blijft gelijk
- Het totale volume neemt toe
- De concentratie neemt af
Als je dit principe snapt, worden de berekeningen een stuk eenvoudiger.
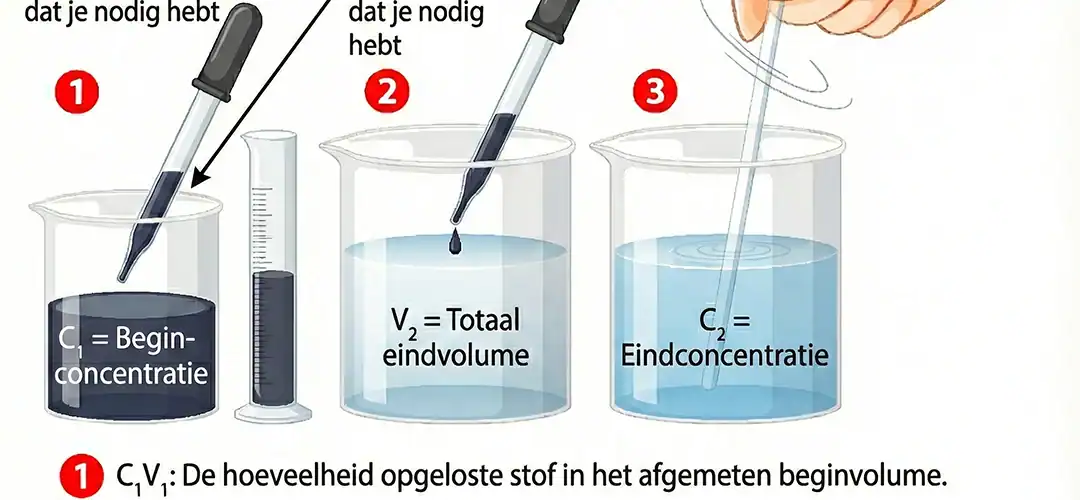
De verdunningsformule uitgelegd (C₁V₁ = C₂V₂)
Voor de meeste verdunningsvraagstukken gebruik je één eenvoudige vergelijking:
C₁V₁ = C₂V₂
Dit betekent:
- C₁ = beginconcentratie (stockoplossing)
- V₁ = volume van de stockoplossing dat je nodig hebt
- C₂ = gewenste concentratie na verdunning
- V₂ = totaal eindvolume van de verdunde oplossing
Waarom werkt deze formule? Omdat de hoeveelheid opgeloste stof vóór en na verdunning gelijk blijft. Je verandert alleen het volume waarin die stof verdeeld is.
Uitgewerkt voorbeeld: een verdunde oplossing bereiden
Laten we het concreet maken.
Doel: bereid 100 mL van een 0,1 M oplossing uit een 1,0 M stockoplossing.
Stap 1: Noteer wat je weet
- C₁ = 1,0 M
- C₂ = 0,1 M
- V₂ = 100 mL
- V₁ = onbekend (dit gaan we berekenen)
Stap 2: Gebruik de formule
C₁V₁ = C₂V₂
Stap 3: Los op naar V₁
V₁ = (C₂ × V₂) / C₁
V₁ = (0,1 × 100) / 1,0
V₁ = 10 mL
Stap 4: Vertaal de berekening naar handelingen in het lab
- Meet 10 mL van de 1,0 M stockoplossing af.
- Breng dit over in een maatkolf.
- Vul aan met gedestilleerd water tot het totaalvolume 100 mL bereikt.
- Meng grondig.
Let op: je voegt niet precies 90 mL water toe. Je vult aan tot 100 mL totaalvolume. Dat kleine detail zorgt vaak voor fouten.
Verdunnen met andere oplosmiddelen (niet alleen water)
Water is het meest gebruikte oplosmiddel in schoollaboratoria, maar veel chemische oplossingen worden verdund met andere vloeistoffen zoals isopropanol, aceton, ethanol of gespecialiseerde organische oplosmiddelen. Het basisprincipe blijft hetzelfde: je verlaagt de concentratie door het totale volume te vergroten terwijl de hoeveelheid opgeloste stof gelijk blijft. Toch brengt werken met niet-waterige oplosmiddelen een paar extra aandachtspunten met zich mee.
Hoe voer je een verdunning praktisch uit?
Als de berekening klopt, is de uitvoering rechttoe rechtaan. Een typische werkwijze:
- Meet eerst de stockoplossing af met een pipet of maatcilinder.
- Breng deze over in een maatkolf of geschikte container.
- Voeg langzaam oplosmiddel toe.
- Stop zodra je de eindvolume-markering bereikt.
- Sluit af en meng voorzichtig door te zwenken of om te keren.
Nauwkeurigheid is hier belangrijker dan snelheid. Haast leidt meestal tot volumefouten of morsen.

Veelgemaakte fouten
Iedereen maakt ze in het begin. Dit zijn de klassiekers:
Toegevoegd volume verwarren met eindvolume
Als er 100 mL eindvolume staat, dan is dat inclusief wat al in de kolf zit.
Eenheden vergeten om te rekenen
Concentraties staan vaak in mol/L en volumes in mL. Zorg dat je consequent rekent.
Te vroeg afronden
Houd extra decimalen aan tijdens het rekenen en rond pas aan het einde af.
Gokken in plaats van rekenen
Verdunnen lijkt eenvoudig, maar verhoudingen raden geeft vaak verkeerde concentraties.
De meeste fouten ontstaan doordat stappen worden overgeslagen, niet doordat de chemie te moeilijk is.
Wat is een seriële verdunning?
Een seriële verdunning is een stapsgewijze methode om zeer lage concentraties te maken. In plaats van direct sterk naar extreem zwak te gaan, werk je in stappen.
Bijvoorbeeld:
- Eerste verdunning: 1 deel oplossing + 9 delen water → 1:10
- Tweede verdunning: herhaal dezelfde stap → 1:100
- Derde verdunning: opnieuw herhalen → 1:1000
Deze methode wordt vaak gebruikt in biologische experimenten en analytische chemie, omdat ze nauwkeuriger is bij zeer lage concentraties.
Zie het als het langzaam dimmen van een lamp in plaats van hem direct op de laagste stand te zetten.
Veiligheid bij het verdunnen van chemicaliën
Ook bij eenvoudige verdunningen gelden basisregels:
- Draag altijd een veiligheidsbril en handschoenen in het lab.
- Voeg geconcentreerd zuur toe aan water, nooit andersom.
- Label verdunde oplossingen direct met concentratie en datum.
- Gebruik schoon glaswerk om verontreiniging te voorkomen.
Veiligheidsregels zijn er niet voor niets. Na verloop van tijd worden ze vanzelf routine.
Snelle samenvatting: verdunnings-spiekbriefje
Onthoud dit tijdens het oefenen:
- Verdunnen verlaagt de concentratie door oplosmiddel toe te voegen.
- De hoeveelheid opgeloste stof blijft gelijk.
- Gebruik de formule C₁V₁ = C₂V₂.
- Verdun tot het eindvolume, niet op basis van een geschatte toevoeging.
- Werk nauwkeurig en label alles.
Verdunnen lijkt in het begin misschien spannend, maar in de kern is het gecontroleerd mengen. Begrijp waarom de formule werkt, volg de stappen consequent en je merkt dat de meeste vraagstukken steeds volgens hetzelfde patroon verlopen. Oefen een paar voorbeelden en het wordt routine in plaats van stress.